本网讯(物质科学与信息技术研究院)近日,我校物质科学与信息技术研究院宋琎教授课题组开发了一种电化学驱动手性路易斯碱催化新策略。该研究通过手性异硫脲催化实现电化学氧化与共价结合自由基中间体的立体化学控制作用,高效合成了多种1,4-二羰基化合物(图1)。相关工作以“Enantioselective radical α-enolation of esters via electrochemical chiral isothiourea catalysis”为题在国际顶级期刊《Nature Catalysis》(SCI IF = 44.6)上在线发表(DOI:10.1038/s41929-025-01408-4)。我校2022级硕士研究生李宁为论文第一作者,宋琎教授为通讯作者,安徽大学为唯一通讯单位。该工作是我校在“电化学合成”研究领域的显著进展。

图1. 发表论文首页
羧酸酯作为一类重要结构单元广泛存在于生物、化学与材料科学领域,其不对称α-官能团化反应在有机合成中具有关键意义。本研究创新性地将手性异硫脲路易斯碱催化与电化学合成相结合,开发了一种新型催化策略:手性异硫脲催化剂与羧酸酯反应生成的C1-烯醇铵盐中间体,通过电化学单电子氧化生成手性异硫脲结合的α-羰基自由基物种,成功实现了与硅烯醇醚的不对称氧化自由基交叉偶联反应(图2)。该策略在在温和条件下高效合成了一系列底物范围宽泛的1,4-二羰基化合物,获得优异的产率和对映选择性(最高达98% e.e.)。机理研究证实,C1-烯醇铵盐中间体的低氧化电位特性有效抑制了外消旋背景反应,同时异硫脲催化剂形成的手性空腔通过对共价键合自由基中间体的立体控制,确保了自由基反应过程的高对映选择性。本研究突破了传统双电子反应模式的限制,将手性异硫脲催化从离子型反应拓展到自由基反应领域,为开发多样化立体可控自由基反应提供了新范式,显著推动了不对称电合成领域的发展。
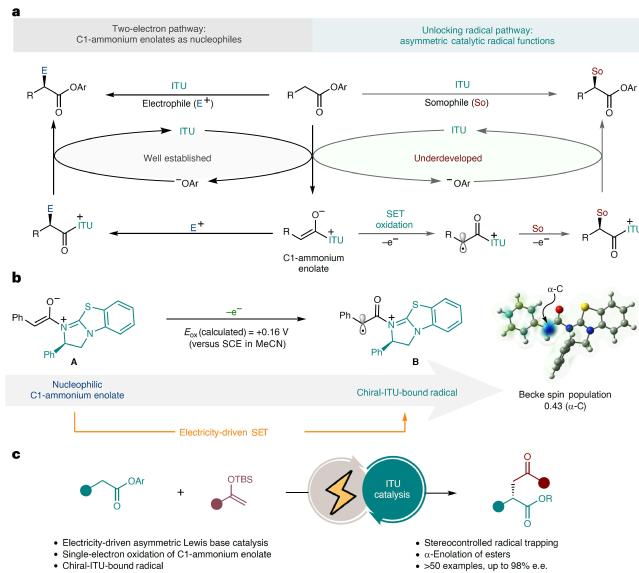
图2. 电化学促进手性异硫脲催化不对称自由基反应模式






 1470
1470 电子营业执照
电子营业执照